酒精是纯净物吗(中考化学重点知识笔记)
100次浏览 发布时间:2024-09-21 09:37:14课题1物质在水中的分散
一、溶解
物质以分子或离子的形式均匀分散到另一种物质中的过程,叫做物质的溶解
二、溶液
1、概念:一种或几种物质分散到另一种物质里形成均一、稳定的混合物。如:蔗糖、食盐溶于水
2、特征:均一性:指溶液各部分密度、浓度、性质都相同
稳定性:指温度不变、溶液久置不出现沉淀,不分层
注意:(1)溶液不一定是无色的。如:碘酒是褐色的。高锰酸钾溶液是紫红色
CuSO4 、CuCl2 、 Cu(NO3)2 溶液是蓝色的(因含有Cu2+)。
FeCl3、 Fe2(SO4)3 、 Fe(NO3)3 溶液是黄色的(因含有Fe3+)。
FeCl2 、 FeSO4 、 Fe(NO3)2 溶液是浅绿色的(因含有Fe2+)。
(2)溶液是均一、稳定的,但均一、稳定的液体不一定是溶液,如:蒸馏水、酒精等纯净物。
3、溶液的判别
(1) 是否具备均一性、稳定性。
(2)是 否为混合物。
【例如】硬水、空气、纯净水属于溶液;泥水,油水,蒸馏水不是溶液。
4、溶液读法:一般读作“xx(溶质)的xx(溶剂)溶液”,水溶液常省掉溶剂水的名称。
常见溶液的溶质、溶剂:
溶液名称 | 碘酒 | 稀盐酸 | 生理盐水 | 石灰水 | 汽水 |
溶质 | I2 | HCl | NaCl | Ca(OH)2 | H2CO3 |
溶剂 | C2H5OH | H2O | H2O | H2O | H2O |
三、影响物质溶解速率快慢的因素:搅拌、升温、将固体研碎。
四、溶解时的吸热或放热现象
溶解吸热(溶液温度降低):如NH4NO3溶解
溶解放热(溶液温度升高):如NaOH固体溶解、浓H2SO4稀释
反应放热(溶液温度升高): 如_CaO固体与水反应
溶解没有明显热现象(溶液温度不变):如NaCl、蔗糖溶解
五、乳化现象
1、乳浊液:小液滴 分散到液体里形成的不均一、不稳定的混合物 ,如 牛奶、豆浆、植物油与水混合
2、悬浊液:固体小颗粒 分散到液体里形成的不均一、不稳定混合物, 如血液、泥水、浑浊的石灰水
3、悬浊液与乳浊液特征:不均一、不稳定。静置后分层
4、乳化剂:能使互不相溶的液体形成稳定乳浊液的物质。常见:肥皂,洗衣粉,洗发水,洗面奶,洗洁精、洗涤灵等
5、乳化作用: 洗洁精能洗掉油污是因为洗洁精具有乳化功能
注意:洗涤剂洗油污是乳化,汽油、酒精洗掉油污是溶解 ,用酸去除铁锈、用醋去除锅垢是化学反应
六、水溶液的某些性质
1、物质溶于水后,凝固点降低,沸点升高。 冬天加盐融雪,高原加盐煮食物
2、由离子构成的物质的水溶液有导电性(有自由移动的离子)如:食盐水能导电,
由分子构成的物质水溶液没有导电性,如:酒精溶液,蔗糖溶液
固体不导电(离子不能自由移动)
总结:
物质导电必备的两个条件:①有带电的 微粒 ,② 带电的粒子能 自由移动
水中加入食盐、硫酸和氢氧化钠等物质后形成溶液,导电性明显 增强 。
课题2溶液
七、溶液组成
溶质:被溶解的物质。(可以是固、液、气体)
.1、组成 溶剂:能溶解其他物质的物质。(水是最常用的溶剂) 空气是溶液
2、溶质和溶剂的判断:
(1)固体、气体溶于液体:液体为溶剂,固体、气体是溶质。
(2)液体溶于液体:有水:水为溶剂,其它为溶质;
无水:量多的为溶剂,量少的为溶质。
(3)根据名称:溶液的名称一般 溶质在前,溶剂在后。水作为溶剂时,一般不读
(4)如果物质在溶解时与水发生了化学变化,溶质是反应后生成的物质。
如:CO2溶于水,溶质是碳酸H2CO3,而不是CO2
CaO溶于水,溶质是氢氧化钙Ca(OH)2,而不是CaO
(5)两种物质反应并形成溶液时,生成物中如有可溶物、沉淀、气体或水时,其中可溶物为溶质,沉淀或逸出的气体不是溶质,生成的水成为溶剂的一部分。
反应物如有剩余且溶于水,则剩余物也为溶质。
如,盐酸和碳酸钠恰好完全反应:2HCl+Na2CO3 === 2NaCl+H2O+CO2↑
反应后形成的溶液中,溶质是NaCl ,生成的水和原溶液中的水是溶剂
思考1:酸和碳酸钠不反应, 溶剂是: , 溶质可能是: 和
或者是: 和
思考2:碳酸钙与盐酸完全反应, 溶剂是: ,溶质是:
思考3:碳酸钙与盐酸不完全反应,溶剂是: ,溶质是:
八、溶质质量分数
1、定义:溶质质量与溶液质量之比。
2、计算式:
①溶质质量分数 溶质的质量÷溶液的质量Χ100%
溶液质量=溶质质量+溶液质量
溶液质量= V(溶液)×ρ(溶液密度)
②溶质质量=溶液质量 × 溶质质量分数
3、注意:求化学反应后所得溶液中溶质质量分数的问题
根据质量守恒定律: 反应后所得溶液质量(g) =反应前物质总质量—生成气体的质量—生成沉淀的质量
4、注意:
(1)溶质质量分数与温度、溶液质量多少无关。
(2)结晶水合物溶于水,溶质是不含结晶水的化合物。
如:CuSO4.5H2O溶于水,溶质是CuSO4
(3)能与水反应的物质溶于水所得溶质是反应后的生成物
(4)若溶质全部溶于水,且不与水发生化学反应,直接利用上述计算式进行计算。
(5)若溶质虽不与水反应,但没有全部溶解,则溶质质量只计算溶解部分,未溶解部分不能参与计算
九、溶液的稀释与浓缩
1、溶液稀释的方法:加溶剂或加入低浓度溶液
2、计算依据:稀释(浓缩)溶液的前后,溶质的质量不变
即 m浓 × c浓 == m稀 × c稀 ( m稀=m浓 +m水 )
3、某溶液质量为A克,溶质质量分数为a%,分别加入下列物质后,溶质质量分数变为b%,则分别对应等式如下:
(1)若加水或蒸发, 则 A x a% == (A + m水)x b%
(2)加低浓度的溶液,则 A x a%+ B x b%== (A+ B)x c%
4、溶液变浓的方法:
(1)加溶质:
变浓后的溶液中溶质的质量=原溶液中溶质的质量+加入的溶质质量,溶液的质量改变
(2)蒸发溶剂:
无晶体析出时,蒸发前后溶质质量不变,溶液质量改变
十、化学方程式与溶质的质量分数的混合计算
1、要用溶质质量列比例式。
2、反应后溶液质量的算法:用反应前固液质量总和减去反应放出的气体及生成的沉淀质量。
例 6g石灰石与47.2g稀盐酸恰好反应,剩余物质量为51g,求剩余溶液溶质质量分数?(杂质不与盐酸反应也不溶于酸)
十一、配制溶质质量分数一定的溶液
(1)用溶质固体和水来配制
步骤:计算、称量、量取、溶解、装瓶贴标签。
仪器:托盘天平、药匙、量筒、胶头滴管、烧杯、玻璃棒。
注意:不能在量筒里溶解或稀释。
(2)用浓溶液稀释
步骤:计算、量取、混匀、装瓶贴标签。
仪器:量筒、胶头滴管、烧杯、玻璃棒。
(3)导致配制的溶液溶质质量分数偏小的原因:
①游码未归零
②物与码放反了,并使用了游码
③称量时左盘垫纸,而右盘没有垫纸
④溶质中含有杂质或者溶质不干燥
⑤称量好的溶质没有完全转移到烧杯中
⑥量取水时 仰视读数(水多)
⑦烧杯内有水或存放溶液的试剂瓶内有水 8.砝码磨损
(4)导致配制的溶液溶质质量分数偏大的原因:
①砝码沾有油污或已生锈
②量取水时,俯视读数
③量好的水在加入溶质中时洒出了
注:已配好的溶液在转移到试剂瓶中洒出,不影响浓度
十二、质量分数的是否改变

课题3物质的溶解性
十三、饱和溶液和不饱和溶液
1、概念: 一定温度下,一定量的溶剂里,不能再溶解 某种溶质时所得溶液,叫做这种溶质的饱和溶液
能继续溶解,叫做这种溶质的不饱和溶液
2、注意:
(1)饱和溶液还可溶解其它溶质,不是不能溶解任何物质
(2)谈到饱和溶液时必须指明温度和一定量溶剂,否则不能判断
(3)饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液
(4)在同一温度下,对于同一种溶质来说,饱和溶液要比不饱和溶液浓
3、判断溶液是否饱和的方法:
①一定温度下继续加入溶质,看溶质能否再溶解。
②看溶液中是否有固体存在,有,一定是该固体物质的饱和溶液
4、饱和溶液与不饱和溶液的相互转化:(一般情况下)
不饱和溶液变饱和方法:①加溶质、②降低温度、③蒸发溶剂
饱和溶液变不饱和方法:①增加溶剂、②升高温度
注:Ca(OH)2不饱和的石灰水变为饱和溶液的方法之一:升高温度
十四、 溶解性
1、概念:溶质溶解在溶剂中的能力
2、不同的物质在水中的溶解能力不同,同种物质在不同的溶剂中溶解能力也不同
十五、固体物质的溶解度
1、概念:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量。
如果不指明溶剂,通常所说的溶解度是物质在水中的溶解度
准确理解概念的四个要素:
(1)条件:“在一定温度下” (2) 标准:“在100g溶剂里”
(3)状态:“达到饱和状态” (4)单位:通常用“克” 作单位。
2、溶解度的含义:表示某温度下,100g溶剂里最多溶解多少克溶质 。
如:200C时,NaCl的溶解度为36g。表示在200C时,在100g水中最多溶解36gNaCl。
3、通过溶解度还可以计算该温度下的饱和溶液中:溶质、溶剂、溶液的质量比。
m(溶质):m(溶剂):m(溶液)=溶解度:100g:(溶解度+100g)
4、饱和溶液的溶质质量分数与溶解度的关系。
溶质质量分数 = 溶解度 ÷ (溶解度+100)Χ100%
5、溶解性与溶解度的关系(一定温度下,物质的溶解性能力越好,溶解度越大)
溶解性 | 易溶 | 可溶 | 微溶 | 难溶 |
溶解度(20℃) | >10g | 1g~10g | 0.01~1g | <0.01g |
6、影响因素:①溶质、溶剂本身的性质(内因) ②温度(外因)
只要温度一定,固体的溶解度 就一定,与溶液多少、溶液是否饱和均无关。
①大多数固体溶解度随温度升高而增大:如KNO3
②少数固体溶解度受温度影响较小:如:NaCl、蔗糖
③少数固体溶解度随温度升高而减小:如Ca(OH)2
7、溶解度的表示方法:溶解度曲线
溶解度曲线:用纵坐标表示溶解度,横坐标表示温度,根据某物质在不同温度时的溶解度,画出该物质的溶解度随温度变化的曲线。
8、解度曲线的意义
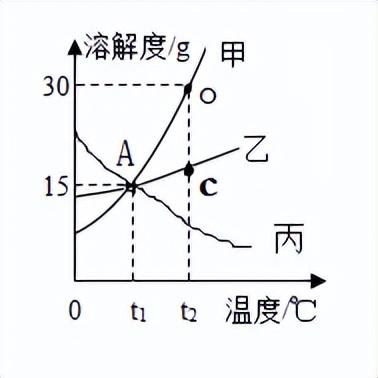
①曲线的意义:表示某物质在不同温度下的溶解度及溶解度随温度变化的情况。
②曲线上的每一点:表示溶质在某温度下的溶解度,溶液是饱和溶液。
③两曲线的交点:表示两种溶质在同一温度下具有相同的溶解度。
④曲线下方的点表示溶液是不饱和溶液。
⑤曲线上方的点表示溶液是饱和溶液,且溶质有剩余。
如上图:
⑥交点A:表示t10C时,物质甲、乙和丙的溶解度相同,为15克。
甲、乙、丙三种物质的饱和溶液的溶质质量分数的大小关系:
甲=乙=丙
⑦O点:表示t20C时,物质甲的溶解度为30克,物质乙溶解度为C克。
t20C时 ,等质量的甲、乙两种物质的饱和溶液,所含溶剂的质量大小关系:甲<乙
9、提纯或结晶的方法:
(1)物质甲溶解度受温度影响__大__,提纯用冷却热饱和溶液(降温结晶)的方法(如KNO3)
(2)物质乙溶解度受温度影响__小__,提纯用 蒸发溶剂_的方法(如NaCl)
(3)物质丙溶解度受温度影响__大__,提纯用升温结晶的方法(如Ca(OH)2 )
(4)t20C时,甲、乙、丙三种饱和溶液,降温到t10C时,会析出晶体的有甲和乙 ,无晶体析出的有丙,甲、乙溶液溶质质量分数变小,丙溶液溶质质量分数不变
(5)分离甲和乙的混合物
甲多乙少----降温结晶法(制成热的饱和溶液--降温结晶--过滤--洗涤--干燥)
乙多甲少----蒸发结晶法(蒸发结晶--过滤--洗涤--干燥)
十六、结晶及其方法
(1)结晶: 已溶解在溶液中的溶质从溶液中以晶体形式析出的过程.
(2)结晶方法:蒸发结晶和降温结晶
(3)蒸发结晶:适用于溶解度受温度影响较小的物质。如NaCl 溶液(海水晒盐)
注意:结晶后剩余溶液、溶质、溶剂的质量都减少。
(4)冷却结晶:适用于溶解度受温度影响较大的物质。如KNO3 溶液。
注意:结晶后剩余溶液、溶质、质量都减少、但溶剂的质量不变。
十七、气体溶解度
1、定义:在101kPa和一定温度下,在1体积水达到饱和时所溶解的气体体积数。
2、影响气体溶解度的因素:气体的性质、温度和压强
温度越高,气体的溶解度越小;压强越大,气体溶解度越大。
十八、浓溶液与稀溶液:一定量的溶液中,含溶质的量相对较多的是浓溶液。反之,是稀溶液。
注:(1)溶液浓稀与是否饱和没有关系。
浓溶液不一定是饱和溶液。 稀溶液不一定是不饱和溶液。
(2)只有在相同温度下,同一溶质的饱和溶液比不饱和溶液浓。

