金刚石和石墨是同素异形体吗
1795次浏览 发布时间:2022-07-31 14:32:51
提起钻石,你可能会想到光彩夺目、闪烁耀眼的精美饰品,以及它昂贵的价格;提起石墨,你可能会想到黑乎乎、滑腻腻的碳棒。纯净的金刚石是无色透明、正八面体形状的固体;石墨是一种深灰色有金属光泽而不透明的细鳞片状固体。石墨很软,在纸上画过可留下痕迹,有滑腻感。金刚石和石墨形或性有着天壤之别,但它们具有相同的质,它们是一对孪生兄弟,都由碳元素组成,被称同素异形体。
金刚石可以用来切割玻璃、做钻头,因为它的硬度很大;石墨可以用来做铅笔芯、润滑剂,这是因为它很软、有滑腻感。按照莫氏硬度标准,金刚石为最高级。金刚石是自然界中天然存在的最坚硬的物质。金刚石和石墨同样由碳原子构成,金刚石为什么会如此的坚硬,这取决于它的分子结构。
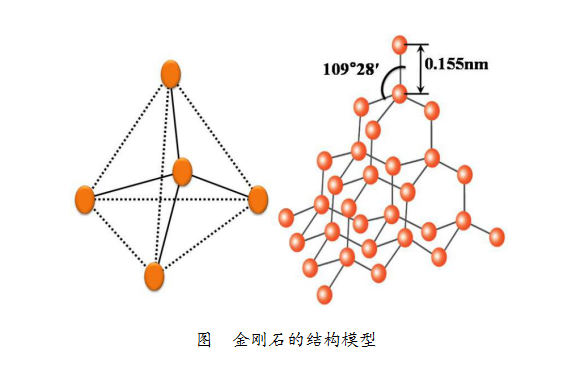
下图是金刚石的结构模型。每个碳原子都与周围的4个碳原子通过强烈的相互作用紧密结合。紧密结合的两个碳原子之间的距离约为0.155nm,从而形成致密的三维结构,正是这种致密的结构,使得金刚石成为天然存在的最坚硬的物质。
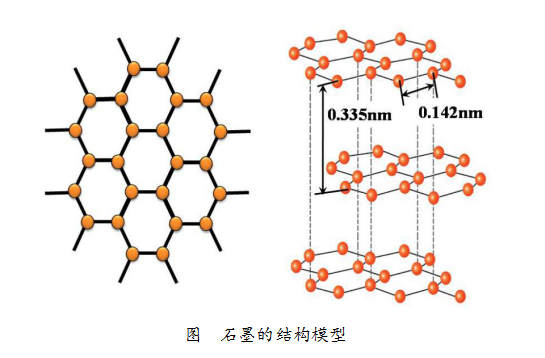
而石墨是层状的结构,就一个片层而言,每1个碳原子会与其周围的3个碳原子通过强烈的相互作用紧密结合,紧密结合的两个碳原子之间的距离约为0.142nm。在石墨中层与层之间相距为0.335nm,由于距离比较大,碳原子的相互作用较弱,因此很容易沿着与层面平行的方向滑动、裂解,所以石墨很软、有滑腻感。
金刚石和石墨相比,结构更为致密。金刚石的密度大约是石墨的1.5倍左右(金刚石的密度约为3.5-3.53g/cm³,石墨的密度约为2.09–2.23g/cm³)。
碳原子通过强烈的相互作用(化学键)紧密结合时,原子间的距离越小,相互作用越强。在石墨的一个片层中,碳原子间的距离比金刚石小,相互作用更强,更难被破坏,所以石墨的熔点更高。
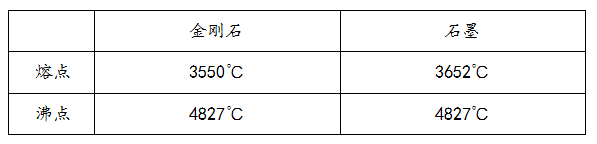
如下表所示,金刚石和石墨的熔点不同,但沸点却相同,这又是为什么呢?物质的物态变化与微粒间的距离是有一定关系的。石墨和金刚石熔化以后,碳原子原来的排列方式被打破,原子间的距离相等,相互作用强度也相同,所以沸点相同。
我们都知道,石墨具有导电性。这与石墨的结构也有密切关系。碳原子最外层有4个电子,在石墨的一个片层中,每个碳原子会与其周围的3个碳原子通过共用电子对形成强烈的相互作用(化学键),每个碳原子只有3个最外层电子参与这种力的形成,这样就会剩下1个自由电子。因为有大量自由电子存在,所以石墨能导电。而金刚石中每个碳原子与其周围的4个碳原子通过共用电子对形成强烈的相互作用,碳原子最外层的4个电子几乎都参与了这种力的形成,基本没有自由电子,所以基本不导电。
结构可以决定性质,金刚石和石墨都由碳原子构成,但是因为原子排列方式不同,导致很多物理性质有很大差异。






