硫酸根离子的空间构型
2423次浏览 发布时间:2022-08-02 11:57:54
第三单元知识课题2原子结构

一、命题规律:
高频考点:粒子构成示意图(10年6考)
二、课标要求:
1、认识物质的微粒性,知道分子、原子、离子是构成物质的微粒
2、原子是由原子核和核外电子构成的、同一元素的原子和离子可以互相转化,
3、初步认识核外电子在化学反应中的作用。
4、知道原子是由原子核和电子构成的
活动与探究
(1)写科普小品:我想象中的原子结构。
三、考查方式
考查原子构成
考查物质的元素组成
考查粒子的核外电子排布
考查元素周期表
考查对元素形成化合物过程的理解
四、知识点:

考点1:原子的构成
1、原子结构
2、原子不显电性。
3、并非所有原子核内都有中子,如氢原子是不含中子。
4、原子核内质子数不一定等于中子数,原子的种类主要由质子数决定。
5、在原子里,核电荷数=质子数=核外电子数,原子不显电性。
考点2: 相对原子质量
1、相对原子质量的标准:以一个碳-12原子质量的1/12为标准,其他原子质量与它相比。
2、表达式:相对原子质量Ar =某元素一个原子的质量/(一个碳12原子的质量×1/12)
3、相对原子质量是一个比值,不是原子的实际质量。
4、原子的质量主要集中在原子核上。
5、相对原子质量≈质子数+中子数(因为原子的质量主要集中在原子核上,质子和中子的相对质量都约为1,电子质量很小,常略去不计)
考点3:核外电子的分层排布
1、原子核外电子按照能量的高低,在离核远近不同的区域运动,也叫做核外电子的分层排布。
2、电子排布——分层排布:第一层不超过2个;第二层不超过8个
3、先排满第一层,再依次排下一层
4、最外层最多排8个电子(只有一个电子层的排2个)
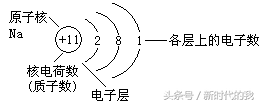
考点4:原子结构示意图
1、原子结构示意图各部分的含义

2、原子最外层电子数为8(氦为2)的结构称为稳定结构。
3、元素的种类主要由核电荷数(质子数)来决定;
4、元素的化学性质主要由元素的原子的最外层电子数决定;
5、原子量主要由质子数和中子数决定。
6、最外层电子数相同其化学性质不一定都相同(Mg,He最外层电子数为2)
7、最外层电子数不同其化学性质有可能相似(He,Ne均为稳定结构)
考点5:离子
1、定义:带电荷的原子(或原子团)。
2、分类
阳离子:带正电荷的离子,如Na+、Mg2+
阴离子:带负电荷的离子,如Cl-、O2-
3、离子符号表示的意义:表示该离子及其带多少个单位的正(或负)电荷。
例如:Mg2+表示一个镁离子,还表示一个镁离子带两个单位的正电荷。
2Mg2+ ——第一个2表示两个镁离子
第二个2表示每个镁离子带两个单位的正电荷
4、离子符号前面的化学计量数(系数)表示离子的个数;
5、离子符号的表示方法:在元素符号(或原子团)右上角表明离子所带的电荷,数值在前,正、负号在后。离子带1个单位的正电荷或1个单位的负电荷,"1"省略不写。如: 阳离子:Na+、Ca2+、Al3+等,阴离子:Cl-、S2‑等
6、微观粒子结构示意图及原子、阳离子、阴离子的判断(10年7考)
7、有关离子的小结
⑴金属离子带正电荷,非金属离子带负电荷;
⑵离子所带的电荷=该元素的化合价
⑶常见原子团离子(请注意上下标)
SO42- 硫酸根离子 CO32- 碳酸根离子 NO3- 硝酸根离子 OH- 氢氧根离子
NH4+ 铵根离子
考点6:原子结构知识中的八种决定关系:
1.质子数决定原子核所带的电荷数(核电荷数)因为原子中质子数=核电荷数。
2.质子数决定元素的种类
3.质子数、中子数决定原子的相对原子质量
因为原子中质子数+中子数=原子的相对原子质量。
4.电子能量的高低决定电子运动区域距离原子核的远近
因为离核越近的电子能量越低,越远的能量越高。
5.原子最外层的电子数决定元素的类别
因为原子最外层的电子数<4为金属,>或=4为非金属,=8(第一层为最外层时=2)为稀有气体元素。
6.原子最外层的电子数决定元素的化学性质
因为原子最外层的电子数<4为失电子,>或=4为得电子,=8(第一层为最外层时=2)为稳定。
7.原子最外层的电子数决定元素的化合价
原子失电子后元素显正价,得电子后元素显负价,化合价数值=得失电子数
8.原子最外层的电子数决定离子所带的电荷数
原子失电子后为阳离子,得电子后为阴离子,电荷数=得失电子数。






